近日,太阳集团tyc234cc张帆团队联合中国科学院天津工业生物技术研究所苏浩团队,在国际权威期刊《Angewandte Chemie International Edition》发表题为“Cytochrome P450 Mediated Cyclohexane Ring Formation in Forazoline Biosynthesis”的研究论文。该研究通过多学科交叉策略,首次揭示海洋抗真菌分子Forazoline A生物合成中关键环己烷结构的自由基环化机制,为应对耐药真菌感染提供了全新药物设计思路。
Forazoline A是由海洋放线菌Actinomadura sp. WMMB-499产生的PK/NRP杂合大环内酯类天然产物,其通过全新作用机制展现出显著体内抗真菌活性,有望突破现有药物的耐药性瓶颈。然而,该分子复杂的生物合成路径及关键后修饰酶功能长期未被阐明。
张帆团队通过基因组挖掘锁定候选基因簇,结合异源表达、基因敲除及同位素标记实验,系统解析了三个细胞色素P450酶(FrazP1P2P3)的功能。其中,P450酶FrazP2被证实可催化1,3,6-三烯前体形成环己烷结构,这是forazoline A骨架构建的核心步骤。
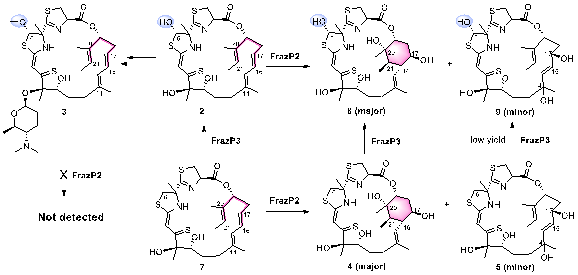
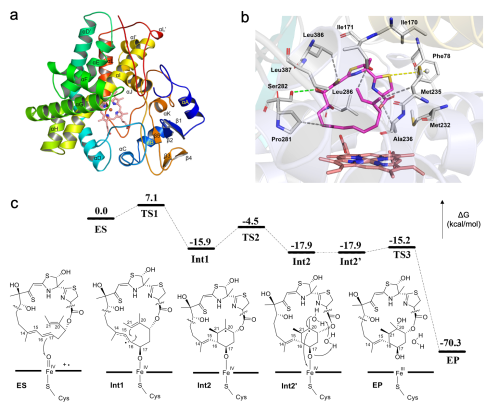
通过解析FrazP2-底物复合物2.3Å高分辨率晶体结构,团队首次捕捉到该酶活性口袋中底物结合的关键构象。结合分子动力学模拟与密度泛函理论(DFT)计算,研究揭示FrazP2通过"氧化-质子转移-环化"多步协同机制实现非经典环化反应,突破了传统P450酶催化模式的认知。此外,研究团队通过异源表达体系获得系列forazoline开环人工产物,其抗真菌活性较天然产物forazoline A提升4–8倍。这一发现揭示了结构柔性在药物膜渗透性中的关键作用,为新一代抗真菌药物设计提供了重要方向。
武汉大学药学院博士生陈心茹和中国科学院天津工业生物技术研究所博士生张玉婕为论文共同第一作者。太阳集团tyc234cc张帆教授和中国科学院天津工业生物技术研究所苏浩副研究员为论文共同通讯作者,论文第一单位为太阳集团tyc234cc、中南医院呼吸与危重症医学科室和泰康生命医学中心。太阳集团tyc234cc陶韦新副教授、硕士生李诗琪和硕士生廖玮霆为本论文做出重要贡献。该研究得到了国家自然科学基金面上项目、国家重点研发计划青年科学家项目、太阳成集团tyc234cc启动经费和太阳成集团tyc234cc泰康生命医学中心的资助。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202504925